Диметилглиоксим
| Диметилглиоксим | |||
|---|---|---|---|
| |||
| Общие | |||
| Хим. формула | C4H8N2O2 | ||
| Физические свойства | |||
| Молярная масса | 116,12 г/моль | ||
| Плотность | 1.38 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 240 - 241 °C | ||
| Классификация | |||
| Рег. номер CAS | 95-45-4 | ||
| PubChem | 135459645 | ||
| Рег. номер EINECS | 202-420-1 | ||
| SMILES | |||
| InChI | |||
| RTECS | EK2975000 | ||
| ChemSpider | 21159429 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||



Диметилглиоксим (2,3-бутандиондиоксим, диоксим диацетила) — органическое соединение, относящееся к оксимам.
Свойства
[править | править код]Диметилглиоксим представляет собой бесцветные кристаллы; tпл 238—240 °C. Диметилглиоксим растворим в спирте, эфире и растворах щелочей; с солями никеля образует красный нерастворимый осадок диметилглиоксимата никеля (C4H7O2N2)2Ni, являющегося внутрикомплексным соединением.
Получение
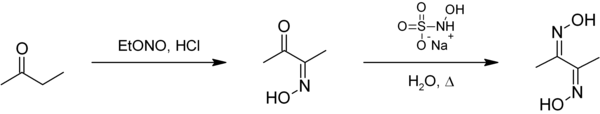
[править | править код]Диметилглиоксим получают действием гидроксиламина NH2OH на диацетил CH3COCOCH3 и др. способами.
Известен удобный лабораторный способ получения диметилглиоксима из метилэтилкетона[1]:
Применение
[править | править код]Диметилглиоксим применяют для качественного и количественного определения палладия и никеля. Как селективный реагент для определения никеля в щелочной среде в присутствии окислителей диметилглиоксим предложен в 1905 Л. А. Чугаевым, поэтому диметилглиоксим иногда называют «реактив Чугаева»[2][3].
При взаимодействии с ионами никеля диметилглиоксим образует красный комплекс, который может быть легко осажден и определен гравиметрически.
Примечания
[править | править код]- ↑ Semon, W. L.; Damerell, V. R. (1943), «Dimethylglyoxime», Org. Synth.; Coll. Vol. 2: 204. Дата обращения: 7 октября 2009. Архивировано из оригинала 28 июля 2009 года.
- ↑ Чугаев Л.А. О металлических соединениях α-диоксимов // Журнал Русского физико-химического общества. — 1905. — Т. 37, вып. 2. — С. 243.
- ↑ Соловьев Ю. И. Исследования Л. А. Чугаева по химии комплексных соединений // История химии в России: Научные центры и основные направления исследований. — М.: Наука, 1985. — С. 275—279.
Литература
[править | править код]- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2 (Даф-Мед). — 671 с. — ISBN 5-82270-035-5.